[ad_1]
La piperina è il principale componente bioattivo del pepe, che gli conferisce pungenza e sapore pungente.
Questo alcaloide naturale ha numerosi effetti sulla salute dimostrati e proprietà terapeutiche benefiche; tuttavia, le sue applicazioni biologiche sono limitate a causa della sua scarsa solubilità in ambienti acquosi.
Ciò sottolinea l’implementazione di approcci di estrazione avanzati che potrebbero migliorare la resa di estrazione della piperina dal pepe e anche lo sviluppo di nuove formulazioni contenenti tale sostanza per migliorare la sua biodisponibilità in vivo.
In un recente studio (condotto da Leila Gorgani, Maedeh Mohammadi, Ghasem D. Najafpour, Maryam Nikzad e pubblicato su Wiley Online Library) sono stati analizzati gli effetti terapeutici e medicinali della piperina, il suo isolamento dal frutto del pepe e lo sviluppo di nuove formulazioni per le sue applicazioni medicinali (farmaceutiche).
E’ stata altresì presentata una revisione approfondita delle tecniche di separazione convenzionali e avanzate per l’estrazione della piperina dal pepe e viene fornito e discusso uno schema delle condizioni più significative per migliorare la resa di estrazione.
E poi sono stati esaminati diversi metodi utilizzati per misurare e quantificare la piperina isolata.
Dalla ricerca è emersa una panoramica dei progressi biotecnologici per le formulazioni di nanoparticelle di piperina o la sua incorporazione nelle formulazioni lipidiche, che potrebbero migliorarne la biodisponibilità.
Entriamo nello specifico dello studio.
Le erbe e le spezie hanno una lunga storia di utilizzo nelle preparazioni culinarie e medicinali. Il delizioso sapore e i benefici per la salute delle spezie le hanno rese ingredienti indispensabili nella lavorazione degli alimenti.
Inoltre, hanno trovato posto in preparazioni di numerosi medicinali per le loro proprietà farmacologiche benefiche.
Tra le spezie, il pepe ha occupato una posizione suprema e unica per la sua caratteristica piccantezza e sapore. Il pepe nero, giustamente soprannominato il Re delle Spezie, è la spezia più importante e più consumata al mondo. È l’unica spezia che viene invariabilmente servita ai tavoli da pranzo ed è un ingrediente inevitabile di molti cibi preparati. Il pepe nero è stato utilizzato per molti scopi in passato, continua ad esserlo attualmente e ci si aspetta che rimanga tale in futuro.
Il valore del pepe è dovuto al suo sapore piccante, attribuito alla presenza di un alcaloide naturale, noto come piperina, oltre che agli oli essenziali volatili. Gli oli volatili, che costituiscono dallo 0,4% al 7% circa del pepe nero (Peter 2006), sono responsabili dell’aroma del pepe, sebbene la piperina, come costituente principale delle oleoresine del pepe, gli conferisca pungenza (Parthasarathy e altri 2008).
La quantità di piperina varia nelle piante appartenenti alla famiglia delle Piperaceae; costituisce dal 2% al 7,4% sia del pepe nero che del pepe bianco (Piper nigrum L .; Ravindran 2003; Peter 2006; Parthasarathy e altri 2008), sebbene alcuni rapporti abbiano indicato un contenuto di piperina più alto del pepe nero fino al 9% (Gaikar e Raman 2002; Agarwal 2010), 4% di frutti di peperone lungo (Piper longum L.) e 4,5% di frutti di peperone lungo balinese (Piper retrofractum Vahl; Gaikar e Raman 2002).
Il contenuto di piperina del pepe può essere influenzato da molti fattori ambientali tra cui il clima, le condizioni di crescita e il suo luogo di origine (Peter 2006).
La piperina, come l’alcaloide più abbondante nel pepe, è stata isolata per la prima volta dall’estratto di pepe di Hans Christian Ørsted nel 1819.
È stata estratta come un composto cristallino giallo con un punto di fusione da 128 a 130 ° C.
La struttura chimica della piperina è stata successivamente identificata come piperoilpiperidina, con la formula chimica di C17H19NO3 e con il nome IUPAC 1‐ (5‐ [1,3 ‐ benzodiossolo ‐ 5 ‐ il] ‐1 ‐ osso ‐ 2,4 ‐ pentadienile) piperidina.
La piperina è risultata essere una base molto debole, che dopo idrolisi acida o alcalina si decompone in una piperina basica volatile, nota come piperidina (C5H11N) e acido piperico (C12H10O4; Pruthi 1999; Agarwal 2010).
La 1 ‐ piperoilpiperidina (piperina) esiste come 4 strutture isomeriche: piperina (isomero trans ‐ trans), isopiperina (isomero cis ‐ trans), chavicina (isomero cis ‐ cis) e isochavicine (isomero trans ‐ cis), come illustrato nella Figura 1 ; tuttavia, i 3 isomeri geometrici della piperina non hanno quasi nessun piccante (Ravindran 2003).
Ricerche successive hanno dimostrato la presenza di altri alcaloidi, tra cui piperanina, piperettina, piperylin A, piperoleina B e pipericina, tutti dotati di un certo grado di piccantezza nell’estratto di pepe.
Tuttavia, il contributo complessivo di questi alcaloidi alla pungenza del pepe è risultato essere piccolo. Le strutture chimiche della piperina e dei suoi analoghi sono illustrate nella Figura 2 (Ravindran 2003; Peter 2006).
Nonostante le controversie sulla natura dei composti responsabili della piccantezza del pepe, la piperina è considerata la principale pungente del pepe in quanto costituisce circa il 98% degli alcaloidi totali del pepe (Hirasa e Takemasa 1998) e; quindi, il contenuto di piperina viene considerato come una misura della pungenza totale del pepe (Parthasarathy e altri 2008).
Usato come medicinale fin dall’antichità.
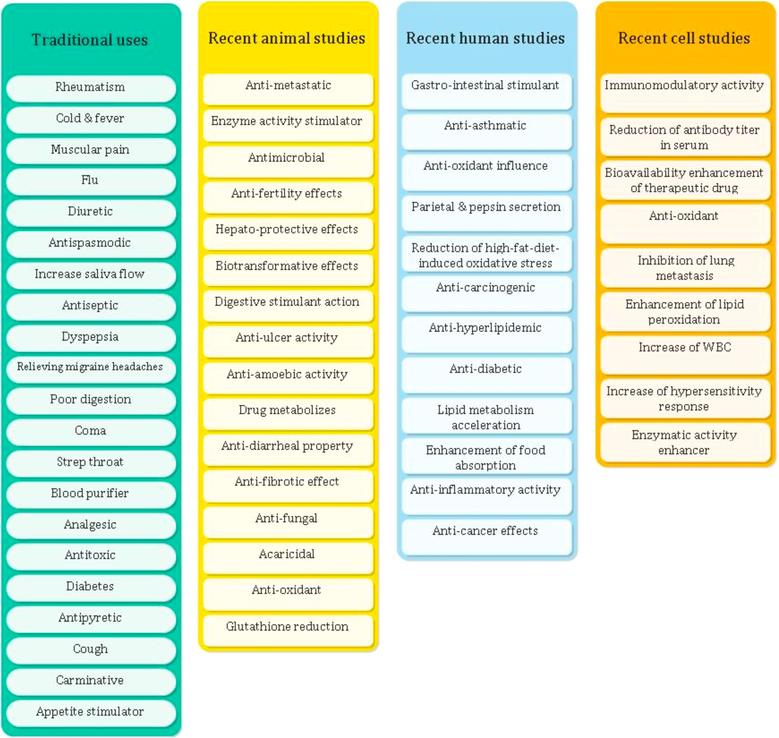
Nell’antica medicina cinese e indiana, il pepe nero era usato come agente medicinale naturale per il trattamento e alleviare dolori, brividi, reumatismi, influenza, dolori muscolari, brividi e febbri.
Nella forma del tè, il pepe nero è stato anche accreditato per alleviare l’emicrania, mal di gola, cattiva digestione e persino coma (Parthasarathy e altri 2008).
Era anche usato per migliorare la circolazione del sangue, aumentare il flusso di saliva e stimolare l’appetito (Pruthi 1993). Recenti indagini hanno dimostrato che la piperina ha attività chemiopreventive e antiossidanti.
Ha anche attività immunomodulatorie, anticancerogene, stimolatorie, epatoprotettive, antinfiammatorie (Darshan e Doreswamy 2004), antimicrobiche (Yang e altri 2002) e antiulcera (Bai e Xu 2000).
La piperina ha anche effetti biotrasformativi e può aumentare la biodisponibilità di diversi farmaci come rifampicina, sulfadiazina, tetraciclina e fenitoina aumentandone l’assorbimento, rallentando il metabolismo del farmaco o tramite una combinazione dei 2 (Atal e altri 1985; Wu 2007).
La piperina mostra un effetto protettivo contro le radiazioni e quindi può essere applicata ai malati di cancro prima della radioterapia (Raman e Gaikar 2002b).
È stato anche riportato che la piperina aumenta notevolmente l’attività della lipasi pancreatica e stimola l’amilasi pancreatica, la tripsina e la chimotripsina (Platel e Srinivasan 2000).
Prove recenti suggeriscono che la piperina potrebbe svolgere un ruolo importante nella riduzione del colesterolo nel sangue, dei trigliceridi e del glucosio (Mueller e Hingst 2013).
Alcuni degli usi tradizionali del pepe e recenti studi sugli effetti terapeutici del pepe / piperina sono riassunti nella Tabella 1 (Srinivasan 2007; Meghwal e Goswami 2013).
Nonostante le ottime proprietà terapeutiche della piperina, è leggermente solubile in acqua (40 mg / L a 18 ° C; Vasavirama e Upender 2014).
La bassa solubilità della piperina in acqua e la sua scarsa dissoluzione è la fase di controllo della velocità nel processo di assorbimento della piperina.
Le attività farmaceutiche della piperina sono limitate a causa della sua bassa solubilità in acqua e perché l’uso di essa ad alte concentrazioni può essere tossico per il sistema nervoso centrale e riproduttivo (Veerareddy e altri 2004; Pachauri e altri 2015). Sono stati fatti tentativi per sviluppare nuove formulazioni per migliorare la biodisponibilità della piperina.
L’uso della moderna nanotecnologia per le formulazioni di nanoparticelle di piperina e il suo incapsulamento in matrici lipidiche sono i progressi più recenti per superare la sua bassa solubilità in acqua.
Questo articolo fornisce una rassegna sulla piperina, il composto bioattivo del pepe e sulle sue proprietà terapeutiche. Il lavoro si concentra sui metodi utilizzati per estrarre la piperina dal pepe, con una revisione dettagliata dei parametri più importanti nel processo di estrazione.
Il documento presenta anche approcci recenti per il miglioramento della biodisponibilità della piperina.
Effetti terapeutici della piperina.
Attività antiossidante.
L’esposizione a radiazioni e inquinanti ambientali, danni ai tessuti, infezioni e processi autoimmuni possono portare alla produzione di radicali liberi (Bagchi e Puri 1998).
I radicali liberi possono causare danni che possono essere alleviati aumentando la concentrazione di antiossidanti nei tessuti.
La piperina ha un’attività antiossidante e può ridurre le sostanze reattive all’acido tiobarbiturico e mantenere i livelli di superossido dismutasi, catalasi, glutatione perossidasi, glutatione ‐ S ‐ transferasi e glutatione; riduce anche lo stress ossidativo indotto dalla dieta ad alto contenuto di grassi nelle cellule (Vijayakumar e altri 2004).
La piperina ha un’attività protettiva del fegato grazie alla sua attività antiossidante. Esperimenti hanno dimostrato che la piperina riduce la perossidazione lipidica sia in vitro che in vivo e previene la diminuzione del glutatione (GSH) e dei tioli totali. GSH coniuga gli xenobiotici che vengono eliminati mediante ulteriore glucuronidazione (Kaul e Kapil 1993).
La piperina ha mostrato un significativo effetto epatoprotettivo sul danno epatico indotto da paracetamolo nei topi grazie alla sua capacità di cattura dei radicali (Sabina e altri 2010). Il pepe e il suo principale composto bioattivo, la piperina, potenziano l’attività degli enzimi di biotrasformazione nel fegato in modo dose-dipendente e, quindi, svolgono un ruolo chemoprotettivo (Singh e Rao 1993).
La piperina somministrata per via orale può avere un effetto stimolante sugli enzimi digestivi del pancreas e dell’intestino; e aumenta anche la secrezione di acidi biliari (Ulbricht e altri 2008).
Attività antitumorale.
La piperina ha attività antitumorale e antitumorale. L’attività antitumorale della piperina può essere dovuta alle sue proprietà immunomodulatorie, inclusa l’attivazione delle risposte immunitarie cellulari e umorali (Sunila e Kuttan 2004).
È stato riportato che la piperina ha ridotto le metastasi polmonari indotte dalle cellule di melanoma B16F-10 mediante l’attivazione di enzimi di protezione antiossidante e la modulazione della perossidazione lipidica (Pradeep e Kuttan 2002). Sono stati segnalati anche gli effetti antiinvasivi della piperina sulle cellule di fibrosarcoma (Hwang e altri 2011).
Il pretrattamento con piperina ha aumentato la sensibilizzazione delle cellule di cancro al seno che sovraesprimono HER2 all’inibizione della crescita e all’apoptosi indotte da paclitaxel (Do e altri 2013).
L’angiogenesi è un segno distintivo della progressione del tumore ed è quindi considerata un obiettivo importante per il trattamento del cancro.
La piperina inibisce il processo angiogenico in vitro ed ex vivo; è stato anche dimostrato che mostra inibizione dell’angiogenesi indotta da cellule di cancro al seno in vivo (Doucette e altri 2013).
I rapporti hanno dimostrato che in un modello di topo nudo xenotrapiantato con cellule di cancro alla prostata, il trattamento con piperina ha ridotto notevolmente la crescita del tumore androgeno-dipendente e indipendente (Samykutty e altri 2013).
Attività antinfiammatoria.
La risposta fisiopatologica dei tessuti viventi alle lesioni viene definita infiammazione, che causa l’accumulo locale di liquido plasmatico e cellule del sangue.
È un meccanismo di difesa che si è evoluto negli organismi superiori per proteggerli da lesioni e infezioni; tuttavia, gli eventi complessi e i mediatori che prendono parte alla reazione infiammatoria possono indurre o sostenere lo sviluppo di molte malattie o addirittura aggravarle.
Per il trattamento terapeutico delle malattie mediate dall’infiammazione è efficace l’uso di agenti antiinfiammatori.
La proprietà antinfiammatoria si riferisce alla capacità di una sostanza o di un trattamento di ridurre l’infiammazione o il gonfiore (Sosa e altri 2002).
La piperina standard, così come gli estratti di esano ed etanolo di piper nigrum L., hanno rivelato una notevole attività analgesica e antinfiammatoria (Tasleem e altri 2014).
Le attività antinfiammatorie della piperina sono state confermate in molti modelli di ratto (Mujumdar e altri 1990).
La piperina ha anche mostrato effetti antireumatici in modelli animali ed effetti antinfiammatori sui sinoviociti simil-fibroblasti stimolati con interleuchina 1β (IL1β) (FLS; Bang e altri 2009).
Inibisce lo shock endotossico indotto da LPS mediante l’inibizione della produzione di IFN di tipo 1, che rende la piperina un utile agente antiinfiammatorio gastrointestinale (Bae e altri 2010).
L’asma è una malattia infiammatoria causata da risposte immunitarie irregolari nella mucosa delle vie aeree, con sintomi quali infiammazione delle vie aeree, produzione estrema di muco delle vie aeree a causa dell’iperplasia delle cellule caliciformi e un aumento dello spessore della parete delle vie aeree.
La piperina ha mostrato profondi effetti inibitori sull’infiammazione delle vie aeree in un modello murino di asma a causa della soppressione delle citochine Th2 (IL ‐ 4, IL ‐ 5, IL ‐ 13), dell’immunoglobulina E, dell’espressione del CCR3 degli eosinofili e dell’espressione del gene TGF-b potenziata nei polmoni.
Pertanto, può essere considerato un possibile immunomodulatore sottoregolando le citochine Th2 (Kim e Lee 2009).
Capacità di bio-potenziamento.
I bio-potenziatori sono facilitatori di farmaci e, in combinazione con i farmaci, possono potenziare l’attività delle molecole di farmaco attraverso percorsi diversi aumentando la biodisponibilità di un farmaco attraverso la membrana, aumentando l’effetto del farmaco per interazione conformazionale e agendo come un recettore del farmaco (Patil e altri 2011).
La piperina può aumentare la biodisponibilità di molti farmaci e può essere applicata come bio-potenziatore. L’assorbimento della piperina attraverso la barriera intestinale è molto rapido. Gli studi hanno indicato che la piperina ha un meccanismo di diffusione passiva, un alto coefficiente di permeabilità apparente e un breve tempo di clearance (Khajuria e altri 1998).
A causa della natura non polare della piperina, può regolare la dinamica della membrana interagendo con i lipidi e le parti idrofobe della proteina, che modificano la conformazione enzimatica a causa di una diminuzione della proprietà dei lipidi di membrana di agire come vincoli sterici alle proteine enzimatiche.
La piperina può aumentare la permeazione attraverso la barriera epiteliale perché può indurre cambiamenti nella dinamica della membrana e nelle caratteristiche di permeazione, insieme all’induzione della combinazione di proteine legate alla funzione citoscheletrica che aumenta la superficie di assorbimento dell’intestino tenue (Khajuria e altri 2002).
Gli esperimenti hanno dimostrato che la piperina ha migliorato la biodisponibilità degli antibiotici β-lattamici come cefotaxime sodico, amoxicillina (Hiwale e altri 2002), ampicillina e altri tipi di antibiotici come la norfloxacina (Janakiraman e Manavalan 2008).
L’effetto inibitorio della piperina sugli enzimi responsabili del metabolismo di questi antibiotici nel fegato può essere la ragione della loro migliore biodisponibilità.
Le combinazioni dell’antibiotico rifampicina con piperina hanno notevolmente migliorato l’effetto inibitorio su Mycobacterium smegmatis rispetto alla sola rifampicina (Balakrishnan e altri 2001).
È stato anche dimostrato che la piperina può potenziare gli effetti farmacocinetici della gatifloxacina, un agente antibatterico, nelle galline ovaiole inibendo gli enzimi responsabili del metabolismo della gatifloxacina nel fegato (Patel e altri 2011).
Il docetaxel è un agente chemioterapico citotossico e recentemente è stato utilizzato come trattamento più importante per il carcinoma prostatico metastatico resistente alla castrazione (CRPC).
L’effetto antitumorale del docetaxel in un modello di xenotrapianto di CRPC umana è stato migliorato dalla co-somministrazione di piperina con docetaxel (Makhov e altri 2012).
La piperina è stata applicata anche per migliorare la biodisponibilità dell’aciclovir.
Il metodo di evaporazione del solvente in emulsificazione è stato utilizzato per preparare microsfere galleggianti caricate con aciclovir e sono stati studiati gli effetti dell’aggiunta di piperina sulla biodisponibilità dell’aciclovir.
I risultati hanno mostrato che l’uso di microsfere contenenti piperina ha aumentato la biodisponibilità relativa dell’aciclovir rispetto alla soluzione farmacologica o alle microsfere prive di piperina (Khatri e Awasthi 2016).
La piperina aumenta anche la biodisponibilità di farmaci a base di erbe e convenzionali come il resveratrolo e la curcumina (Mueller e Hingst 2013). Gli studi hanno dimostrato che la piperina ha aumentato notevolmente la biodisponibilità in vivo del resveratrolo inibendone il metabolismo e diminuendo la dose richiesta di resveratrolo in un contesto clinico (Johnson e altri 2011).
La piperina ha anche aumentato la biodisponibilità della curcumina e migliorato i suoi effetti protettivi contro il disturbo cognitivo indotto da stress cronico imprevedibile (CUS) e il danno ossidativo associato nei topi.
L’aumento della biodisponibilità della curcumina potrebbe essere dovuto all’effetto preventivo della piperina sul metabolismo intestinale ed epatico della curcumina (Rinwa e Kumar 2012).
È stato segnalato che le nanoparticelle caricate con due farmaci curcumina-piperina (Cu-Pi) sono state in grado di superare la bassa biodisponibilità orale della curcumina e la limitazione del targeting delle cellule tumorali nel trattamento del cancro (Moorthi e altri 2012).
La curcumina con nanoparticelle cubosomiche caricate con piperina ha anche migliorato la biodisponibilità orale e la distribuzione tissutale della curcumina (Tu e altri 2014).
Per ulteriori approfondimenti (in inglese): LINK.
Bibliografia.
- Agarwal OP. 2010. Chemistry of organic natural products. Meerut, India: Goel Publishing House.
- Akbarzadeh A, Rezaei‐Sadabady R, Davaran S, Joo SW, Zarghami N, Hanifehpour Y, Samiei M, Kouhi M, Nejati‐Koshki K. 2013. Liposome: classification, preparation, and applications. Nanoscale Res Lett 8: 1– 9.
- Angell CA, Ansari Y, Zhao Z. 2012. Ionic liquids: past, present, and future. Faraday Discuss 154: 9– 27.
- Aparicio S, Atilhan M, Karadas F. 2010. Thermophysical properties of pure ionic liquids: review of present situation. Ind Eng Chem Res 49: 9580– 95.
- Ashour EA, Majumdar S, Alsheteli A, Alshehri S, Alsulays B, Feng X, Gryczke A, Kolter K, Langley N, Repka MA. 2016. Hot melt extrusion as an approach to improve solubility, permeability, and oral absorption of a psychoactive natural product, piperine. J Pharm Pharmacol 68: 989– 98.
- Atal C, Dubey R, Singh J. 1985. Biochemical basis of enhanced drug bioavailability by piperine: evidence that piperine is a potent inhibitor of drug metabolism. J Pharmacol Exp The 232: 258– 62.
- Azmir J, Zaidul I, Rahman M, Sharif K, Mohamed A, Sahena F, Jahurul M, Ghafoor K, Norulaini N, Omar A. 2013. Techniques for extraction of bioactive compounds from plant materials: a review. J Food Eng 117: 426– 36.
- Bae G‐S, Kim M‐S, Jung W‐S, Seo S‐W, Yun S‐W, Kim SG, Park R‐K, Kim E‐C, Song H‐J, Park S‐J. 2010. Inhibition of lipopolysaccharide‐induced inflammatory responses by piperine. Eur J Pharmacol 642: 154– 62.
- Bagchi K, Puri S. 1998. Free radicals and antioxidants in health and disease. East Mediterr Health J 4: 350– 60.
- Bai Y‐F, Xu H. 2000. Protective action of piperine against experimental gastric ulcer. Acta Pharmacol Sin 21: 357– 9.
- Balakrishnan V, Varma S, Chatterji D. 2001. Piperine augments transcription inhibitory activity of rifampicin by severalfold in Mycobacterium smegmatis. Curr Sci 80: 1302– 5.
- Balasubramanian D, Srinivas V, Gaikar V, Sharma M. 1989. Aggregation behavior of hydrotropic compounds in aqueous solution. J Phys Chem 93: 3865– 70.
- Bang JS, Choi HM, Sur B‐J, Lim S‐J, Kim JY, Yang H‐I, Yoo MC, Hahm D‐H, Kim KS. 2009. Anti‐inflammatory and antiarthritic effects of piperine in human interleukin 1β‐stimulated fibroblast‐like synoviocytes and in rat arthritis models. Arthritis Res Ther 11: 1– 9.
- Bayley S. 1951. The dielectric properties of various solid crystalline proteins, amino acids, and peptides. Trans Faraday Soc 47: 509– 17.
- Benita S. 2005. Microencapsulation: methods and industrial applications. Boca Raton, Fla.: CRC Press.
- Benthin B, Danz H, Hamburger M. 1999. Pressurized liquid extraction of medicinal plants. J Chromatogr A 837: 211– 9.
- Bhat M, Gaikar V. 1999. Characterization of interaction between butyl benzene sulfonates and cetyl trimethylammonium bromide in mixed aggregate systems. Langmuir 15: 4740– 51.
- Boddupalli BM, Ramani R, Subramaniam B, Anisetti RN. 2012. In vitro and in vivo evaluation of hepato‐protection and anti‐ulcer activities of piperine gastro retentive micropspheres. Asian Pac J Trop Biomed 2: 1237– 40.
- Cao X, Ye X, Lu Y, Yu Y, Mo W. 2009. Ionic liquid‐based ultrasonic‐assisted extraction of piperine from white pepper. Anal Chim Acta 640: 47– 51.
- Chan C‐H, Yusoff R, Ngoh G‐C, Kung FW‐L. 2011. Microwave‐assisted extractions of active ingredients from plants. J Chromatogr A 1218: 6213– 25.
- Chatel G, MacFarlane D. 2014. Ionic liquids and ultrasound in combination: synergies and challenges. Chem Soc Rev 43: 8132– 49.
- Chowdhury SA, Vijayaraghavan R, MacFarlane D. 2010. Distillable ionic liquid extraction of tannins from plant materials. Green Chem 12: 1023– 8.
- Cintas P, Luche J‐L. 1999. Green chemistry. The sonochemical approach. Green Chem 1: 115– 25.
- Committee AM. 1984. Application of gas‐liquid chromatography to the analysis of essential oils. Part XI. Monographs for seven essential oils. Analyst 109: 1343– 60.
- Darshan S, Doreswamy R. 2004. Patented antiinflammatory plant drug development from traditional medicine. Phytother Res 18: 343– 57.
- De Castro ML, Garcıa‐Ayuso L. 1998. Soxhlet extraction of solid materials: an outdated technique with a promising innovative future. Anal Chim Acta 369: 1– 10.
- Do MT, Kim HG, Choi JH, Khanal T, Park BH, Tran TP, Jeong TC, Jeong HG. 2013. Antitumor efficacy of piperine in the treatment of human HER2‐overexpressing breast cancer cells. Food Chem 141: 2591– 9.
- Doucette CD, Hilchie AL, Liwski R, Hoskin DW. 2013. Piperine, a dietary phytochemical, inhibits angiogenesis. J Nutr Biochem 24: 231– 9.
- Dutta S, Bhattacharjee P. 2015. Enzyme‐assisted supercritical carbon dioxide extraction of black pepper oleoresin for enhanced yield of piperine‐rich extract. J Biosci Bioeng 120: 17– 23.
- Elnaggar YS, Etman SM, Abdelmonsif DA, Abdallah OY. 2015. Intranasal piperine‐loaded chitosan nanoparticles as brain‐targeted therapy in Alzheimer’s disease: optimization, biological efficacy, and potential toxicity. J Pharm Sci 104: 3544– 56.
- Entezari MH, Kruus P. 1996. Effect of frequency on sonochemical reactions II. Temperature and intensity effects. Ultrason Sonochem 3: 19– 24.
- Epstein WW, Netz DF, Seidel JL. 1993. Isolation of piperine from black pepper. J Chem Educ 70: 598– 599.
- Eskilsson CS, Björklund E. 2000. Analytical‐scale microwave‐assisted extraction. J Chromatogr A 902: 227– 50.
- Gaikar VG, Raman G. 2002. Process for extraction of piperine from piper species. Google Patents.
- Graham HD. 1965a. Quantitative determination of piperine. I. The Komarowsky reaction. J Food Sci 30: 644– 50.
- Graham HD. 1965b. Quantitative determination of piperine. II. Direct determination with phosphoric acid. J Food Sci 30: 651– 5.
- Graham HD. 1965c. Reaction of piperine with nitric acid. Adaptation to quantitative assay of the piperine content of pepper. J Pharm Sci 54: 319– 21.
- Grant E, Halstead BJ. 1998. Dielectric parameters relevant to microwave dielectric heating. Chem Soc Rev 27: 213– 24.
- Gursoy RN, Benita S. 2004. Self‐emulsifying drug delivery systems (SEDDS) for improved oral delivery of lipophilic drugs. Biomed Pharmacother 58: 173– 82.
- Henglein A, Gutierrez M. 1993. Sonochemistry and sonoluminescence: effects of external pressure. J Phys Chem 97: 158– 62.
- Herrero M, Cifuentes A, Ibanez E. 2006. Sub‐and supercritical fluid extraction of functional ingredients from different natural sources: plants, food‐by‐products, algae and microalgae: a review. Food Chem 98: 136– 48.
- Herrero M, Mendiola JA, Cifuentes A, Ibáñez E. 2010. Supercritical fluid extraction: recent advances and applications. J Chromatogr A 1217: 2495– 511.
- Hirasa K, Takemasa M. 1998. Spice science and technology. Boca Raton, Fla.: CRC Press.
- Hiwale A, Dhuley J, Naik S. 2002. Effect of co‐administration of piperine on pharmacokinetics of beta‐lactam antibiotics in rats. Ind J Exp Biol 40: 277– 81.
- Huddleston JG, Visser AE, Reichert WM, Willauer HD, Broker GA, Rogers RD. 2001. Characterization and comparison of hydrophilic and hydrophobic room temperature ionic liquids incorporating the imidazolium cation. Green Chem 3: 156– 64.
- Huie CW. 2002. A review of modern sample‐preparation techniques for the extraction and analysis of medicinal plants. Anal Bioanal Chem 373: 23– 30.
- Hwang YP, Yun HJ, Kim HG, Han EH, Choi JH, Chung YC, Jeong HG. 2011. Suppression of phorbol‐12‐myristate‐13‐acetate‐induced tumor cell invasion by piperine via the inhibition of PKCα/ERK1/2‐dependent matrix metalloproteinase‐9 expression. Toxicol Lett 203: 9– 19.
- Jain S, Meka SRK, Chatterjee K. 2016. Engineering a piperine eluting nanofibrous patch for cancer treatment. ACS Biomater Sci Eng 2: 1376– 85.
- Janakiraman K, Manavalan R. 2008. Studies on effect of piperine on oral bioavailability of ampicillin and norfloxacin. Afr J Trad Compl Altern Med 5: 257– 62.
- Jessop PG. 2011. Searching for green solvents. Green Chem 13: 1391– 8.
- Johnson JJ, Nihal M, Siddiqui IA, Scarlett CO, Bailey HH, Mukhtar H, Ahmad N. 2011. Enhancing the bioavailability of resveratrol by combining it with piperine. Mol Nutr Food Res 55: 1169– 76.
- Kanaki N, Dave M, Padh H, Rajani M. 2008. A rapid method for isolation of piperine from the fruits of Piper nigrum Linn. J Natur Med 62: 281– 3.
- Kappe CO, Stadler A, Dallinger D. 2012. Microwaves in organic and medicinal chemistry. New Jersey, N.J.: John Wiley & Sons.
- Kaul I, Kapil A. 1993. Evaluation of liver protective potential of piperine: an active principle of black pepper. Planta Med 59: 413– 17.
- Khajuria A, Thusu N, Zutshi U. 2002. Piperine modulates permeability characteristics of intestine by inducing alterations in membrane dynamics: influence on brush border membrane fluidity, ultrastructure, and enzyme kinetics. Phytomedicine 9: 224– 31.
- Khajuria A, Zutshi U, Bedi K. 1998. Permeability characteristics of piperine on oral absorption: an active alkaloid from peppers and a bioavailability enhancer. Ind J Exp Biol 36: 46– 50.
- Khatri S, Awasthi R. 2016. Piperine containing floating microspheres: an approach for drug targeting to the upper gastrointestinal tract. Drug Delivery Transl Res 6: 299– 307.
- Kim SH, Lee YC. 2009. Piperine inhibits eosinophil infiltration and airway hyperresponsiveness by suppressing T cell activity and Th2 cytokine production in the ovalbumin‐induced asthma model. J Pharm Pharmacol 61: 353– 9.
- Kumoro A, Singh H, Hasan M. 2009. Solubility of piperine in supercritical and near critical carbon dioxide. Chin J Chem Eng 17: 1014– 20.
- Kurzhals H‐A, Hubert P. 1980. Extraction of plant and animal materials. German patent 2844781.
- Lang Q, Wai CM. 2001. Supercritical fluid extraction in herbal and natural product studies: a practical review. Talanta 53: 771– 82.
- Lee J, Lee SC, Acharya G, Chang C‐J, Park K. 2003. Hydrotropic solubilization of paclitaxel: analysis of chemical structures for hydrotropic property. Pharm Res 20: 1022– 30.
- Leonard N, Manske R, Holms H. 1960. The alkaloids, Vol. 7. New York/London: Academic Press.
- Maherani B, Arab‐Tehrany E, R Mozafari M, Gaiani C, Linder M. 2011. Liposomes: a review of manufacturing techniques and targeting strategies. Curr Nanosci 7: 436– 52.
- Makhov P, Golovine K, Canter D, Kutikov A, Simhan J, Corlew MM, Uzzo RG, Kolenko VM. 2012. Co‐administration of piperine and docetaxel results in improved antitumor efficacy via inhibition of CYP3A4 activity. Prostate 72: 661– 7.
- Mandal V, Mohan Y, Hemalatha S. 2007. Microwave assisted extraction—an innovative and promising extraction tool for medicinal plant research. Pharmacogn Rev 1: 7– 18.
- Mason T, Chemat F, Vinatoru M. 2011. The extraction of natural products using ultrasound or microwaves. Curr Org Chem 15: 237– 47.
- Mason TJ. 1999. Ultrasonically assisted extraction of bioactive principles from plants and their constituents. Adv Sonochem 5: 209.
- Meghwal M, Goswami T. 2013. Piper nigrum and piperine: an update. Phytother Res 27: 1121– 30.
- Meireles MAA. 2008. Extracting bioactive compounds for food products: theory and applications. Boca Raton, Fla.: CRC Press.
- Merisko‐Liversidge EM, Liversidge GG. 2008. Drug nanoparticles: formulating poorly water‐soluble compounds. Toxicol Pathol 36: 43– 8.
- Mishra SP, Gaikar VG. 2009. Hydrotropic extraction process for recovery of forskolin from Coleus forskohlii roots. Ind Eng Chem Res 48: 8083– 90.
- Mohanraj V, Chen Y. 2007. Nanoparticles‐a review. Trop J Pharm Res 5: 561– 73.
- Moorthi C, Krishnan K, Manavalan R, Kathiresan K. 2012. Preparation and characterization of curcumin–piperine dual drug loaded nanoparticles. Asian Pac J Trop Biomed 2: 841– 8.
- Mueller K, Hingst J. 2013. The athlete’s guide to sports supplements. Illinois, Ill.: Human Kinetics.
- Mujumdar AM, Dhuley JN, Deshmukh VK, Raman PH, Naik SR. 1990. Antiinflammatory activity of piperine. Jpn J Med Sci Biol 43: 95– 100.
- Mukhopadhyay M. 2000. Natural extracts using supercritical carbon dioxide. Boca Raton, Fla.: CRC Press.
- Nair KP. 2011. Agronomy and economy of black pepper and cardamom. Elsevier. Amsterdam, Netherlands.
- Noyer I, Fayet B, Pouliquen‐Sonaglia I, Guerere M, Lesgard J. 1999. Quantitative analysis of pungent principles of pepper oleoresins: comparative study of 3 analytical methods. Analysis 27: 69– 74.
- Pachauri M, Gupta ED, Ghosh PC. 2015. Piperine loaded PEG‐PLGA nanoparticles: preparation, characterization, and targeted delivery for adjuvant breast cancer chemotherapy. J Drug Delivery Sci Technol 29: 269– 82.
- Pal SL, Jana U, Manna P, Mohanta G, Manavalan R. 2011. Nanoparticle: an overview of preparation and characterization. J App Pharm Sci 1: 228– 34.
- Parthasarathy VA, Chempakam B, Zachariah TJ. 2008. Chemistry of spices. London: CABI.
- Patel S, Devada S, Patel H, Patel N, Bhavsar S, Thaker A. 2011. Influence of co‐administration of piperine on pharmacokinetic profile of gatifloxacin in layer birds. Glob Vet 7: 427– 32.
- Patil UK, Singh A, Chakraborty AK. 2011. Role of piperine as a bioavailability enhancer. Int J Recent Adv Pharmac Res 4: 16– 23.
- Pentak D. 2016. In vitro spectroscopic study of piperine‐encapsulated nanosize liposomes. Eur Biophys J 45: 175– 86.
- Peter KV. 2006. Handbook of herbs and spices. Sawston, UK: Woodhead Publishing.
- Pethig R. 1985. Dielectric and electrical properties of biological materials. J Bioelectricity 4: 7– 9.
- Platel K, Srinivasan K. 2000. Influence of dietary spices and their active principles on pancreatic digestive enzymes in albino rats. Food/Nahrung 44: 42– 6.
- Pourmortazavi SM, Hajimirsadeghi SS. 2007. Supercritical fluid extraction in plant essential and volatile oil analysis. J Chromatogr A 1163: 2– 24.
- Pradeep C, Kuttan G. 2002. Effect of piperine on the inhibition of lung metastasis induced B16F‐10 melanoma cells in mice. Clin Exp Metastasis 19: 703– 8.
- Priprem A, Chonpathompikunlert P, Sutthiparinyanont S, Wattanathorn J. 2011. Antidepressant and cognitive activities of intranasal piperine‐encapsulated liposomes. Adv Biosci Biotechnol 2: 108– 16.
- Pruthi J. 1999. Quality assurance in spices and spice products, modern methods of analysis. New Delhi, India: Allied Publishers Ltd.
- Pruthi JS. 1993. Major spices of India: crop management and post‐harvest technology. New Delhi, India: Indian Council of Agricultural Research.
- Rajopadhye AA, Namjoshi TP, Upadhye AS. 2012. Rapid validated HPTLC method for estimation of piperine and piperlongumine in root of Piper longum extract and its commercial formulation. Braz J Pharmacog 22: 1355– 61.
- Raman G, Gaikar VG. 2002a. Extraction of piperine from Piper nigrum (black pepper) by hydrotropic solubilization. Ind Eng Chem Res 41: 2966– 76.
- Raman G, Gaikar VG. 2002b. Microwave‐assisted extraction of piperine from Piper nigrum. Ind Eng Chem Res 41: 2521– 8.
- Raso J, Manas P, Pagan R, Sala FJ. 1999. Influence of different factors on the output power transferred into medium by ultrasound. Ultrason Sonochem 5: 157– 62.
- Rastogi V, Shukla SS, Singh R, Lal N, Yadav P. 2016. Microspheres: a promising drug carrier. J Drug Deliv Ther 6: 18– 26.
- Rathod SS, Rathod VK. 2014. Extraction of piperine from Piper longum using ultrasound. Ind Crops Prod 58: 259– 64.
- Ravindran P. 2003. Black pepper: Piper nigrum. Boca Raton, Fla.: CRC Press.
- Reverchon E, De Marco I. 2006. Supercritical fluid extraction and fractionation of natural matter. J Supercrit Fluids 38: 146– 66.
- Ridhurkar D, Vajdai A, Zsigmond Z. 2016. Hot‐melt extrusion (HME) and its application for pharmacokinetic improvement of poorly water soluble drugs. Pharmacol, Toxicol Biomed Reports 2: 47– 51.
- Rinwa P, Kumar A. 2012. Piperine potentiates the protective effects of curcumin against chronic unpredictable stress‐induced cognitive impairment and oxidative damage in mice. Brain Res 1488: 38– 50.
- Rostagno MA, Prado JM. 2013. Natural product extraction: principles and applications. London: Royal Society of Chemistry.
- Sabina EP, Souriyan ADH, Jackline D, Rasool MK. 2010. Piperine, an active ingredient of black pepper attenuates acetaminophen‐induced hepatotoxicity in mice. Asian Pac J Trop Dis 3: 971– 6.
- Samykutty A, Shetty AV, Dakshinamoorthy G, Bartik MM, Johnson GL, Webb B, Zheng G, Chen A, Kalyanasundaram R, Munirathinam G. 2013. Piperine, a bioactive component of pepper spice exerts therapeutic effects on androgen‐dependent and androgen‐independent prostate cancer cells. Planta Med 8: e65889.
- Sankar KU. 1989. Studies on the physicochemical characteristics of volatile oil from pepper (Piper nigrum) extracted by supercritical carbon dioxide. J Sci Food Agric 48: 483– 93.
- Shao B, Cui C, Ji H, Tang J, Wang Z, Liu H, Qin M, Li X, Wu L. 2015. Enhanced oral bioavailability of piperine by self‐emulsifying drug delivery systems: in vitro, in vivo and in situ intestinal permeability studies. Drug Deliv 22: 740– 7.
- Singh A, Rao A. 1993. Evaluation of the modulatory influence of black pepper (Piper nigrum, L.) on the hepatic detoxication system. Cancer Lett 72: 5– 9.
- Singh D. 2014. Advances in plant biopesticides. Berlin: Springer.
- Singh NK, Kumar P, Gupta DK, Singh S, Singh VK. 2011. UV‐spectrophotometric method development for estimation of piperine in Chitrakadi vati. Der Pharmacia Lettre 3: 178– 82.
- Soppimath KS, Kulkarni AR, Rudzinski WE, Aminabhavi TM. 2001. Microspheres as floating drug‐delivery systems to increase gastric retention of drugs. Drug Metab Revi 33: 149– 60.
- Sosa S, Balick M, Arvigo R, Esposito R, Pizza C, Altinier G, Tubaro A. 2002. Screening of the topical anti‐inflammatory activity of some Central American plants. J Ethnopharmacol 81: 211– 5.
- Sovová H, Jez J, Bártlová M, St’astová J. 1995. Supercritical carbon dioxide extraction of black pepper. J Supercrit Fluids 8: 295– 301.
- Srinivasan K. 2007. Black pepper and its pungent principle ‐ piperine: a review of diverse physiological effects. Crit Rev Food Sci Nutr 47: 735– 48.
- Subbarao CV, Chakravarthy IK, Sai Bharadwaj A, Prasad KM. 2012. Functions of hydrotropes in solutions. Chem Eng Technol 35: 225– 37.
- Subramanian R, Subbramaniyan P, Ameen JN, Raj V. 2011. Double bypasses Soxhlet apparatus for extraction of piperine from Piper nigrum. Arabian J Chem In press.
- Sun Y, Liu D, Chen J, Ye X, Yu D. 2011. Effects of different factors of ultrasound treatment on the extraction yield of the all‐trans‐β‐carotene from citrus peels. Ultrason Sonochem 18: 243– 9.
- Sunila E, Kuttan G. 2004. Immunomodulatory and antitumor activity of Piper longum Linn. and piperine. J Ethnopharmacol 90: 339– 46.
- Tainter DR, Grenis AT. 2001. Spices and seasonings: a food technology handbook. New Jersey, N.J.: John Wiley & sons.
- Tasleem F, Azhar I, Ali SN, Perveen S, Mahmood ZA. 2014. Analgesic and anti‐inflammatory activities of Piper nigrum L. Asian Pac J Trop Dis 7: 461– 8.
- Toma M, Vinatoru M, Paniwnyk L, Mason T. 2001. Investigation of the effects of ultrasound on vegetal tissues during solvent extraction. Ultrason Sonochem 8: 137– 42.
- Tu Y, Fu J, Sun D, Zhang J, Yao N, Huang D, Shi Z. 2014. Preparation, characterisation and evaluation of curcumin with piperine‐loaded cubosome nanoparticles. J Microencapsulation 31: 551– 9.
- Ulbricht C, Chao W, Costa D, Rusie‐Seamon E, Weissner W, Woods J. 2008. Clinical evidence of herb‐drug interactions: a systematic review by the natural standard research collaboration. Curr Drug Metab 9: 1063– 120.
- Upadhyay V, Sharma N, Joshi HM, Malik A, Mishra M, Singh B, Tripathi S. 2013. Development and validation of rapid RPHPLC, method for estimation of piperine in Piper nigrum L. Int J Herb Med 1: 6– 9.
- Vasavirama K, Upender M. 2014. Piperine: a valuable alkaloid from piper species. Int J Pharm Pharm Sci 6: 34– 8.
- Veerareddy P, Vobalaboina V. 2008. Pharmacokinetics and tissue distribution of piperine lipid nanospheres. Die Pharmazie‐ Int J Pharmac Sci 63: 352– 5.
- Veerareddy P, Vobalaboina V, Nahid A. 2004. Formulation and evaluation of oil‐in‐water emulsions of piperine in visceral leishmaniasis. Die Pharmazie‐ Int J Pharmac Sci 59: 194– 7.
- Vijayakumar R, Surya D, Nalini N. 2004. Antioxidant efficacy of black pepper (Piper nigrum L.) and piperine in rats with high‐fat‐diet‐induced oxidative stress. Redox Report 9: 105– 10.
- Vinatoru M. 2001. An overview of the ultrasonically assisted extraction of bioactive principles from herbs. Ultrason Sonochem 8: 303– 13.
- Vishvnath G, Jain U. 2011. Estimation of piperine by UV‐spectrophotometric method in herbal formulation, Pippli churna. Int J Res Pharmac Biomed Sci 2: 550– 3.
- Vitzthum O, Hubert P. 1978. Process for the production of spice extracts. Google Patents.
- Vyas J, Itankar P, Tauqeer M, Kelkar A, Agrawal M. 2013. Development of HPTLC method for estimation of piperine, guggulsterone E and Z in polyherbal formulation. Pharmacogn J 5: 259– 64.
- Wang L, Weller CL. 2006. Recent advances in extraction of nutraceuticals from plants. Trends Food Sci Technol 17: 300– 12.
- Wang Y, You J, Yu Y, Qu C, Zhang H, Ding L, Zhang H, Li X. 2008. Analysis of ginsenosides in Panax ginseng in high pressure microwave‐assisted extraction. Food Chem 110: 161– 7.
- Wasserscheid P, Welton T. 2008. Ionic liquids in synthesis. Wiley Online Library.
- Winton AL, Winton KB. 1945. The analysis of foods. John Wiley and Sons Inc. New York.
- Wu H. 2007. Isolation and characterization of natural products from ginger and Allium ursinum. ProQuest.
- Wu H, Chen M, Fan Y, Elsebaei F, Zhu Y. 2012. Determination of rutin and quercetin in Chinese herbal medicine by ionic liquid‐based pressurized liquid extraction–liquid chromatography–chemiluminescence detection. Talanta 88: 222– 9.
- Xiao W, Han L, Shi B. 2008. Microwave‐assisted extraction of flavonoids from Radix astragali. Sep Purif Technol 62: 614– 8.
- Xu J, Wang W, Liang H, Zhang Q, Li Q. 2015. Optimization of ionic liquid‐based ultrasonic‐assisted extraction of antioxidant compounds from Curcuma longa L. using response surface methodology. Ind Crops Prod 76: 487– 93.
- Yamaguchi T, Kamezawa K, Iwaya K, Sato Y, Miyaji T, Bounoshita M, Tognarelli DJ, Saito M. 2011. Analysis of piperine in peppers using on‐line SFE‐UHPLC with photodiode array detection. Am Lab 43: 29– 31.
- Yang Y‐C, Lee S‐G, Lee H‐K, Kim M‐K, Lee S‐H, Lee H‐S. 2002. A piperidine amide extracted from Piper longum L. fruit shows activity against Aedes aegypti mosquito larvae. J Agric Food Chem 50: 3765– 7.
- Yang Y‐C, Wei M‐C, Huang T‐C, Lee S‐Z, Lin S‐S. 2013. Comparison of modified ultrasound‐assisted and traditional extraction methods for the extraction of baicalin and baicalein from Radix scutellariae. Ind Crops Prod 45: 182– 90.
- Yang Y, Zhang F. 2008. Ultrasound‐assisted extraction of rutin and quercetin from Euonymus alatus (Thunb.) Sieb. Ultrason Sonochem 15: 308– 13.
- Yusuf M, Khan M, Khan RA, Ahmed B. 2013. Preparation, characterization, in vivo, and biochemical evaluation of brain targeted Piperine solid lipid nanoparticles in an experimentally induced Alzheimer’s disease model. J Drug Targeting 21: 300– 11.
[ad_2]
Fonte articolo




